Somalogic公司專注在開發適體應用於蛋白質體學的研究,於去年2023年該公司已經針對人類的基因開發出~11000個對應的適體(其適體平台- SomaScan),以供研究分子交互作用、途徑及篩選疾病的生物標幟。
適體是一種短鏈的單股核酸分子(DNA 或 RNA),經摺疊的三級結構的構型,可以選擇性地結合特定的標靶分子。適體與抗體在結合特定標地的能力相似,但它們由核酸而不是蛋白質組成。以下是適體的一些要點:
適體的化學組成
1.
適體通常由 20-80 個核苷酸組成。
它們可以形成獨特的三級結構,使能夠以高親和力和特異性結合到特定目標。
適體的應用
1.
治療:適體可用作藥物來抑製或調節其標靶分子的功能。
2.
診斷:它們可以作為生物感測器和診斷分析中的識別元件。
3.
研究工具:適體可用於研究分子交互作用和途徑。
4.
優點:
- 對其標靶具有高特異性和親和力。
- 與抗體相比,分子較小,所以更容易滲透組織。
- 易於合成和化學修飾。
-通常比蛋白質更穩定,且不太可能引發免疫反應。
5.
挑戰:
儘管化學修飾可以提高其穩定性,但適體可以被生物系統中的核酸酶降解。
適體的開發和優化可能既耗時又昂貴。
總體而言,適體代表了生物技術中多功能且強大的工具,其潛在應用涵蓋醫學、診斷和基礎研究。
適體的發現
適體的發現可以追溯到上個世紀1990 年代初,兩個獨立的研究團隊同時開發了篩選及優化適體的方法,其關鍵技術發展的里程碑是SELEX(Systematic Evolution of Ligands by
EXponential enrichment,指數富集配體系統演化)技術的發展。以下是這項發現的簡要記事:
-Larry Gold 的團隊[1]:,Dr. Larry Gold 和他在科羅拉多大學的團隊開發了
SELEX 流程。他們展示了可以與特定標靶結合的RNA分子的選擇,從拉丁語“aptus”創造了術語“適體”,意思是“適合”。
-Jack Szostak[2] 的團隊:Dr. Jack Szostak 和他在哈佛大學的團隊也獨立開發了類似的技術,並且大約在同一時間發表了他們的發現。他們專注於選擇能夠與特定配體結合的RNA分子。
1. 早期應用:
初步研究表明,核酸可以在體外進化,以高特異性和親和力與各種標地結合。這些早期的研究範例主要關注 RNA 適體,但考量DNA較為穩定、不易降解的性質,後來擴展到 DNA 適體。
2. 進一步的發展:
SELEX 技術得到了改進和擴展,可以為多種標地選擇適體,包括小分子、蛋白質和細胞。研究人員也開發了透過化學修飾來增強適體穩定性和結合特性的方法。
適體的發現和 SELEX 製程的發展代表了分子生物學和生物技術的重大進步,為研究、診斷和治療應用開闢了新的途徑。
SomaLogic公司利用SELEX建立適體技術的獨特蛋白質體學平台
SomaLogic 由 Larry Gold 博士於 1999 年創立,如前所述,Larry Gold 博士是適體的發明者之一,也是用於創建適體的 SELEX 技術的先驅。公司團隊開發了基於適體技術的獨特蛋白質體學平台,稱為 SomaScan,現已發展成為蛋白質體學領域的領導者。
SomaLogic公司利用SELEX技術,開發識別人類的全蛋白質體(proteome)-高親和力和高特異性的DNA適體分子。 SELEX 過程涉及多輪迭代的選擇、擴增和富集,以從大量隨機序列中分離出各個人類蛋白質的最佳結合適體,SELEX 流程的概述如下(圖一):
-初始隨機序列文庫:合成1015條隨機序列的單股 DNA分子的大型文庫。該文庫包含多種潛在的適體。
-隨機序列文庫與標的蛋白質結合:DNA文庫目標分子混合,只有能夠與標靶結合的核酸序列才會形成複合物。
-將結合序列(適體-標的蛋白複合物)與未結合序列分離:通常是藉由生物素(biotin)-適體結合卵白素(steptoavidin)磁珠,以分離出適體-標的蛋白複合物。
-洗脫:然後將結合的適體從標地分子上洗脫下來,這些序列是對標地分子表現出高親和力的候選序列。
-放大及定序:利用PCR 擴增洗脫的適體,並對各個候選適體進行定序,以鑑定與標地結合的特定核酸序列。
- 迭代輪次:以上步驟重複多次,每輪都會增加選擇的嚴格性,以提高適體對標靶的親和力和特異性。例如藉由調整標的蛋白質的反應濃度以篩選出高親和力的適體、或藉由延長和標的蛋白質的反應時間以篩選出低解離速率的適體等。這些適體設計對其目標蛋白具有高結合親和力,通常解離常數 (Kd) 在nM至pM 範圍內。這種高親和力確保適體即使在低濃度下也能有效捕獲並結合蛋白質[3]。
SomaLogic 開發的適體為 SOMAmer 試劑(商品名),這些SOMAmer是經過修飾的適體(圖二),旨在對其蛋白質標靶具有高親和力、特異性和低解離速率,並且這些修飾增強了適體的穩定性和結合特性,使它們更適合用於人類各種蛋白質分析應用。
截至2023年年底,SomaLogic已經開發超過 11,000 種蛋白質的SOMAmer,使其平台-SomaScan成為最全面的蛋白質體學檢測之一。
SomaScan蛋白質體學平台介紹:
SomaScan 平台是 SomaLogic 開發的高通量蛋白質體檢測平台,使用 SOMAmer同時測量生物樣本中成千上萬種蛋白質的含量。其檢測流程如下(圖三):
步驟A,SOMAmer製備:SOMAmer是 SomaScan 平台的關鍵組件,其接有螢光標幟-光照分解化學基-生物素的基團,螢光標幟可為作為定量的量測來源。
步驟B,與標的蛋白質結合:於待測樣品中加入 SOMAmer,SOMAmer 與其各自的目標蛋白結合,形成 SOMAmer-蛋白質複合物;再藉SOMAmer接著的生物素(biotin)-結合卵白素(steptoavidin)磁珠,以分離出SOMAmer-標的蛋白複合物。
步驟C,加入將生物素耦合反應劑,以將分離得之標的蛋白接上生物素。
步驟D,以高能量光源光照分解螢光基團及生物素之間化學基,而將SOMAmer-蛋白質複合物釋出到反應液中。
步驟E,加入帶有多負電的聚合物,以去除非特異性結合的蛋白質-SOMAmer,單純藉由離子鍵結的結合,於此會被大量的多負電的聚合物競爭而分開,此步驟增強測定的特異性。
步驟F,加入接有卵白素(steptoavidin)磁珠,以將SOMAmer-標的蛋白複合物固著在載體上,這第二輪磁珠吸附的設計,可以純化得到捕獲到標的蛋白SOMAmer。
步驟G,從磁珠載體上洗脫結合的 SOMAmer,帶有螢光的SOMAmer準備用於下一步的檢測。
步驟H,定量每一種SOMAmer-每一種SOMAmer的螢光亮度正比於其捕獲到標的蛋白量。量測每一種SOMAmer的螢光亮度的方法是藉由DNA晶片,在晶片表面微陣列有各個SOMAmer互補序列的探針,藉由hybridization反應將SOMAmer固定在晶片的對應探針位置,再以螢光掃描儀讀取每一SOMAmer探針的螢光訊號,其中螢光訊號值與樣品中每種蛋白質的濃度成正比。
SomaScan蛋白質體學平台的特點:
1.
SOMAmer 設計為對其目標蛋白具有高結合親和力,通常解離常數 (Kd) 在nM至pM 範圍內。
如前所述,Somalogic公司利用SELEX方法選殖出低解離常數的SOMAmer,這種高親和力確保 SOMAmers 即使在低濃度下也能有效捕獲並結合蛋白質
2.
以測量單一樣本中數千種蛋白質(截至2024年5月,已逾11,000 個),使其成為最全面的蛋白質體學檢測之一。
這約11,000個SOMAmer在各生物途徑的分布至少皆有60%的占比(圖四)。
3.
SomaScan的動態範圍(dynamic range)可達10階(1010)
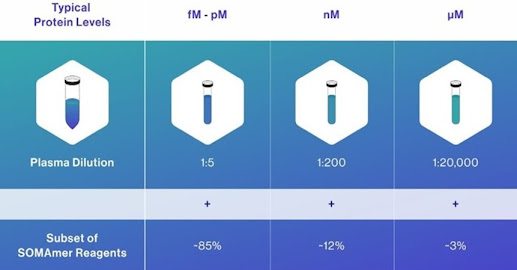
SomaScan 的主要特點之一是其寬廣的動態範圍,通常跨越約 10 個數量級。可檢測和定量各種濃度的蛋白質,這意味著平台可以測量從非常低(pico mole)到非常高(micro mole)的蛋白質濃度,使其適合分析蛋白質濃度變化很大的複雜生物樣本,如血漿或血清等生物檢體。
SomaScan 對這類型樣品使用多重系列稀釋- 透過分析不同稀釋度的樣品,平台可以準確測量同一樣品中高濃度和低濃度的蛋白質,這種方法有助於擴大蛋白質濃度的可測量範圍。以血清/血漿檢體為例(圖五),SomaScan平台將其11K SOMAmer依血清/血漿檢體蛋白質的特質分成三組:豐富度高者(mM),檢體先稀釋2萬倍、中度豐富者(nM) 稀釋2佰倍、低度豐富者(fM-pM)稀釋5倍後,再行SOMAmer量測,如此,可以擴增104的動態範圍,再加上平台使用的螢光偵測的賦予的106的動態範圍,即可達到約 1010的寬廣度。
4.
低變異係數 (CV)
於生物醫學的應用
1. 發現生物標記並應用於臨床診斷:基於上述優點,SomaScan適用於識別各種疾病的蛋白質生物標記物,包括癌症、心血管疾病和神經系統疾病,而在生物標記開發並經臨床試驗後,這些蛋白質生物標記可以應用於診斷測試,有助於疾病檢測和監測。例如以色列的生醫公司OncoHost就是基於SomaScan平台和利用人工智慧分析來了解和預測患者對癌症治療的反應。其主要技術平台 PROphet[6]將蛋白質體分析與機器學習演算法結合,以識別和分析癌症患者血液樣本中的蛋白質生物標記,檢測的結果有助於了解個體對癌症治療反應。這使得醫療人員能夠針對個別患者制定治療計劃,從而有可能提高治療的有效性並減少不良反應。鑑於與這些治療相關的複雜性和不同的患者反應,PROphet 在免疫治療中的應用尤其重要- 免疫療法利用人體的免疫系統來對抗癌症,對某些患者非常有效,但對其他患者呈現無效甚至有害。 有鑑於此,PROphet 旨在透過為免疫療法提供預測見解和個人化治療建議來解決這種變異性,PROphet 可根據患者的蛋白質體數據建議最有效的免疫療法和其他治療(例如化療、標靶治療)的組合,這樣量身定制的檢測可以提高癌症免疫治療的效果。
2. 致病機轉的發現
於疾病的演進過程中,研究人員可以分析相關受影響的器官或組織的蛋白質體,進而推斷出參與疾病過程的下游訊息通路,幫助我們了解疾病的發病機制,甚至可為藥物開發提供新的靶點、或進行疾病相關的精準健康管理。
例如已經有越來越多的臨床數據觀察顯示,感染 COVID-19 的孕婦承受較嚴重的後遺症和產科併發症的風險,但是其中的機制未明,而Gomez-Lopez等研究人員(2023)[7]使用 SomaScan 平台量測血漿樣本以探討懷孕婦女感染 COVID-19的反應(圖六),實驗設計為收集四個族群的血漿樣本,分別是沒有懷孕且沒有感染 COVID-19、沒有懷孕但感染 COVID-19、孕婦且沒有感染 COVID-19、孕婦但感染 COVID-19,並且將感染COVID-19的病徵依嚴重程度分危急(Critical)、嚴重(Severe)、中度(Moderate)、輕微(Mild)、無症狀(Asymptom)等五個等級。
1. 妊娠期反應程度減弱(圖七):研究發現,COVID-19 引起的血漿蛋白譜變化與病徵嚴重程度呈正比關係,但是懷孕婦女組的變化蛋白種類為沒有懷孕者的1/2(1072 vs. 2096),且蛋白變化量幅度也較低,例如同為嚴重(Severe)組,無懷孕組的變化斜率為0.94、懷孕組為0.88;這顯示在懷孕期間會減弱相關COVID-19感染的反應。
|
|
B |
|
|
|
2. 感染COVID-19共有的特異性的變化:以生物途徑富集分析懷孕和非懷孕的個體都表現有差異豐度蛋白質,兩組COVID-19 患者皆表現出與細胞黏附、免疫反應以及對受傷和血液凝固的反應(圖八)。
3.
懷孕婦女感染COVID-19特有的變化
針對 COVID-19的感染,作者進一步進行懷孕和非懷孕患者之間血漿蛋白質差異分析,結果發現有 33種蛋白質有差異變化(圖九A,)這其中包含的血管生成和參與傷口癒合的蛋白質以及警報素(alarmin)、細胞激素和生長因子,其中懷孕組較非懷孕組表現量低的蛋白質有包括血管內皮生長因子
受體1(VEGF-sR1或sFLT-1)和血管張力素原(AGT)等血管生成以及發炎反應相關分子。這顯示懷孕期間的免疫反應似乎是為了在保護胎兒和控制感染之間取得平衡,這可以解釋為什麼懷孕婦女感染COVID-19嚴重後果的風險增加。
|
A |
B |
|
|
|
藉由SomaScan平台,可以了解懷孕期間的獨特免疫調節,這可以解釋為什麼孕婦會面臨更嚴重的 COVID-19 後果。這些發現有助於了解妊娠期 COVID-19 的發病機制,並建議罹患COVID-19懷孕婦女需要採取量身定制的醫療方法,以降低後遺症和產科併發症的風險。
[1] Tuerk and Gold. (1990).
Systematic evolution of ligands by exponential enrichment: RNA ligands to
bacteriophage T4 DNA polymerase. Science.
249: 505–510.
[2] Ellington and Szostak.
(1990). In vitro selection of RNA
molecules that bind specific ligands. Nature.
346: 818–822.
[3] Ochsner et al. (2014). Systematic selection of modified aptamer pairs for diagnostic sandwich assays Biotechniques. 1;56(3):125-8.
[4] Sun et al. (2018). Genomic atlas of the
human plasma proteome. Nature, 558(7708):73-79.
[5] Candia et al.(2017). Assessment of Variability in the SOMAscan Assay. Sci Rep. 27;7(1):14248.
[6] OncoHost
| Innovating Precision Oncology Solutions: https://www.oncohost.com/
[7] Gomez-Lopez
et al. (2023). Pregnancy-specific
responses to COVID-19 revealed by high-throughput proteomics of human plasma. Commun
Med (Lond). 4;3(1):48.










留言
張貼留言